Đồng vị là một khái niệm cơ bản và quan trọng trong hóa học, dùng để mô tả các dạng khác nhau của cùng một nguyên tố hóa học. Điểm đặc biệt của các đồng vị là các nguyên tử của chúng có cùng số proton trong hạt nhân, nhưng lại khác nhau về số neutron. Sự khác biệt về số neutron này dẫn đến sự khác nhau về số khối (tổng số proton và neutron) giữa các đồng vị. Mặc dù có cùng số proton, quyết định tính chất hóa học của nguyên tố, sự khác biệt về khối lượng do số neutron thay đổi có thể ảnh hưởng đến một số tính chất vật lý và làm cho đồng vị trở nên hữu ích trong nhiều lĩnh vực khoa học và đời sống.
Khái niệm đồng vị đóng vai trò thiết yếu trong nhiều ngành. Trong y học, đồng vị phóng xạ được sử dụng rộng rãi trong chẩn đoán hình ảnh (ví dụ: PET scan sử dụng đồng vị carbon-11, fluorine-18) và điều trị ung thư (ví dụ: Iốt-131 cho tuyến giáp, Coban-60 cho xạ trị). Trong địa chất, phương pháp định tuổi bằng đồng vị carbon-14 là công cụ không thể thiếu để xác định tuổi của các mẫu vật hữu cơ cổ xưa, hay định tuổi đá bằng đồng vị uranium-chì. Vật lý hạt nhân nghiên cứu sâu về cấu trúc hạt nhân và các phản ứng hạt nhân thường liên quan đến các đồng vị, đặc biệt là các đồng vị không bền (phóng xạ) và các đồng vị có thể phân hạch như Uranium-235 làm nhiên liệu cho các nhà máy điện hạt nhân.
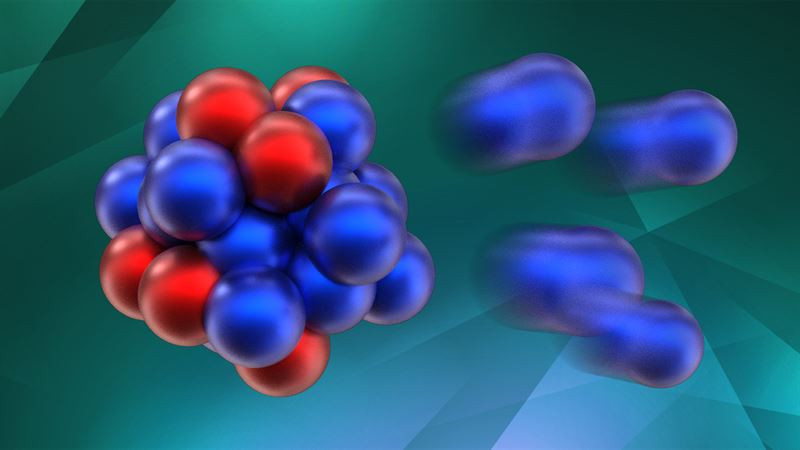
 Minh họa cấu tạo nguyên tử của các đồng vị: cùng số proton, khác số neutron.
Minh họa cấu tạo nguyên tử của các đồng vị: cùng số proton, khác số neutron.
Ngoài ra, đồng vị còn có những ứng dụng thực tiễn khác. Trong nông nghiệp, đồng vị được dùng để nghiên cứu sự hấp thụ và chuyển hóa dinh dưỡng của cây trồng, giúp tối ưu hóa việc bón phân. Trong khoa học môi trường, đồng vị được sử dụng làm chất đánh dấu để theo dõi đường đi của nước ngầm, sự phát tán của chất ô nhiễm hoặc nghiên cứu chu trình các nguyên tố trong hệ sinh thái. Trong công nghiệp, kỹ thuật kiểm tra không phá hủy bằng bức xạ từ đồng vị phóng xạ giúp kiểm tra chất lượng vật liệu, phát hiện khuyết tật trong các cấu trúc kim loại hoặc đường ống. Hiểu rõ về đồng vị là gì và những ứng dụng đa dạng này giúp chúng ta thấy được tầm quan trọng của chúng trong khoa học công nghệ hiện đại.
Những khái niệm nền tảng để tính toán liên quan đến đồng vị
Để làm việc hiệu quả với các bài toán hay ứng dụng liên quan đến đồng vị, đặc biệt là việc tính toán phần trăm hay khối lượng của các đồng vị, chúng ta cần nắm vững một số khái niệm hóa học cơ bản. Những khái niệm này bao gồm cấu tạo nguyên tử, nguyên tử khối và nguyên tử khối trung bình. Việc hiểu rõ mối liên hệ giữa các khái niệm này sẽ giúp giải quyết các bài tập một cách chính xác và hiểu sâu hơn về bản chất của nguyên tố và các đồng vị của nó.
Xem Thêm Bài Viết:- Chân váy trắng mặc với áo màu gì đẹp nhất
- Khám Phá Các Bức Vẽ Tranh Phong Cảnh Lớp 7 Đẹp Nhất
- Khối A07 Gồm Môn Gì? Thông Tin Chi Tiết
- Bộ Sưu Tập Hình Ảnh Bầu Trời Đêm Anime Đẹp Nhất
- Khám Phá Hiện Tượng Tam Sao Thất Bản Vẽ Tranh
Nguyên tử
Nguyên tử là đơn vị cơ bản nhất của vật chất, là hạt nhỏ nhất của một nguyên tố hóa học còn giữ được tính chất hóa học của nguyên tố đó. Mỗi nguyên tử được cấu tạo từ ba loại hạt hạ nguyên tử chính: proton, neutron và electron.
Phần trung tâm của nguyên tử là hạt nhân, chứa các proton mang điện tích dương (+) và neutron không mang điện. Số lượng proton trong hạt nhân (được gọi là số nguyên tử, ký hiệu là Z) là yếu tố quyết định một nguyên tử thuộc về nguyên tố hóa học nào. Ví dụ, mọi nguyên tử có 6 proton đều là nguyên tử Carbon (C), còn nguyên tử có 8 proton là Oxy (O).
 Sơ đồ cấu tạo nguyên tử cơ bản gồm hạt nhân (proton, neutron) và electron.
Sơ đồ cấu tạo nguyên tử cơ bản gồm hạt nhân (proton, neutron) và electron.
Xung quanh hạt nhân là các electron mang điện tích âm (-) di chuyển trong các vùng không gian được gọi là obitan nguyên tử hoặc vỏ electron. Mặc dù khối lượng electron rất nhỏ so với proton và neutron, chúng đóng vai trò cực kỳ quan trọng trong việc xác định tính chất hóa học của nguyên tố thông qua sự tương tác và liên kết với các nguyên tử khác.
Các nguyên tử của cùng một nguyên tố (cùng số proton Z) có thể có số lượng neutron khác nhau. Đây chính là nguồn gốc của khái niệm đồng vị. Sự khác biệt về số neutron này không làm thay đổi tính chất hóa học cơ bản của nguyên tố, nhưng lại ảnh hưởng đến khối lượng của nguyên tử.
Nguyên tử khối
Nguyên tử khối là khối lượng của một nguyên tử, thường được đo bằng đơn vị khối lượng nguyên tử thống nhất (amu hoặc u). Khối lượng này chủ yếu tập trung ở hạt nhân, là tổng khối lượng của các proton và neutron (vì khối lượng của electron rất nhỏ và thường được bỏ qua trong tính toán này).
Vì các đồng vị của cùng một nguyên tố có số neutron khác nhau, chúng sẽ có nguyên tử khối khác nhau. Số khối (A) của một đồng vị được tính bằng tổng số proton (Z) và số neutron (N) (A = Z + N). Nguyên tử khối thực tế của một đồng vị gần bằng giá trị của số khối của nó tính bằng đơn vị amu. Ví dụ, đồng vị Carbon-12 (C-12) có 6 proton và 6 neutron, số khối là 12, nguyên tử khối gần bằng 12 amu. Đồng vị Carbon-13 (C-13) có 6 proton và 7 neutron, số khối là 13, nguyên tử khối gần bằng 13 amu.
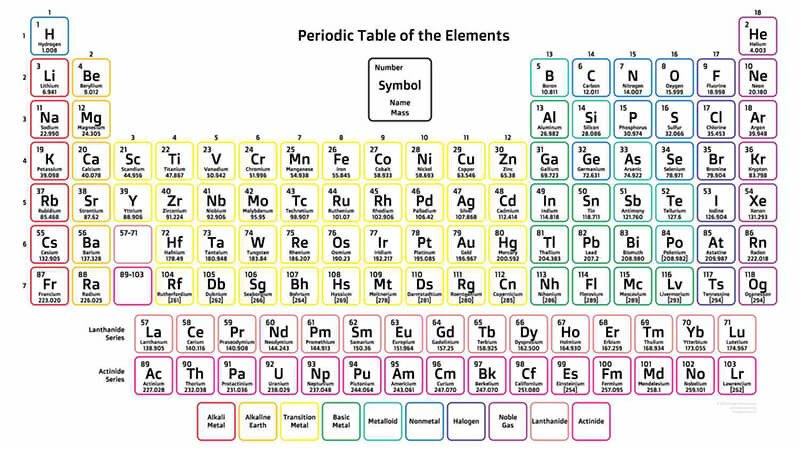 Bảng tuần hoàn hóa học hiển thị nguyên tử khối trung bình của các nguyên tố.
Bảng tuần hoàn hóa học hiển thị nguyên tử khối trung bình của các nguyên tố.
Trên bảng tuần hoàn hóa học, giá trị được ghi dưới ký hiệu của mỗi nguyên tố không phải là nguyên tử khối của một đồng vị cụ thể, mà là nguyên tử khối trung bình của nguyên tố đó. Giá trị này là khối lượng trung bình có tính đến tỷ lệ phần trăm phong phú tự nhiên của tất cả các đồng vị bền của nguyên tố.
Nguyên tử khối trung bình
Nguyên tử khối trung bình (hay khối lượng nguyên tử tương đối trung bình) của một nguyên tố là giá trị trung bình có trọng số của khối lượng các đồng vị bền của nguyên tố đó, dựa trên tỷ lệ phần trăm tồn tại tự nhiên của mỗi đồng vị. Công thức tính nguyên tử khối trung bình ((overline{A})) như sau:
[ overline{A} = frac{(A_1 times %_1) + (A_2 times %_2) + … + (A_n times %_n)}{100} ]Trong đó:
- (A_1, A_2, …, A_n) là nguyên tử khối (gần bằng số khối) của các đồng vị 1, 2, …, n.
- (%_1, %_2, …, %_n) là tỷ lệ phần trăm tồn tại tự nhiên của các đồng vị 1, 2, …, n (với tổng (%_1 + %_2 + … + %_n = 100%)).
Ví dụ, Clo (Cl) trong tự nhiên tồn tại chủ yếu dưới hai đồng vị: (text{Cl}^{35}) với nguyên tử khối xấp xỉ 35 amu và tỷ lệ tự nhiên khoảng 75,77%; và (text{Cl}^{37}) với nguyên tử khối xấp xỉ 37 amu và tỷ lệ tự nhiên khoảng 24,23%. Nguyên tử khối trung bình của Clo được tính là:
[ overline{A}_{Cl} = frac{(35 times 75,77) + (37 times 24,23)}{100} approx 35,45 text{ amu} ] Công thức và khái niệm tính nguyên tử khối trung bình từ các đồng vị.
Công thức và khái niệm tính nguyên tử khối trung bình từ các đồng vị.
Giá trị 35,45 amu này chính là giá trị nguyên tử khối của Clo được ghi trên bảng tuần hoàn hóa học. Việc tính toán nguyên tử khối trung bình là cần thiết vì trong thực tế, các nguyên tố thường là hỗn hợp của các đồng vị theo tỷ lệ nhất định.
Các bài tập điển hình về đồng vị trong Hóa học
Các bài tập về đồng vị là một phần quan trọng trong chương trình hóa học phổ thông, giúp củng cố kiến thức về cấu tạo nguyên tử và rèn luyện kỹ năng tính toán. Dưới đây là một số dạng bài tập thường gặp.
Ví dụ 1: Tính phần trăm tồn tại của đồng vị
Đề bài: Nguyên tố X có hai đồng vị bền là (text{X}^A) và (text{X}^B). Biết tổng số khối của hai đồng vị là 76. Hiệu số neutron của hai đồng vị là 2. Đồng vị (text{X}^A) chiếm 25% tổng số nguyên tử. Tính nguyên tử khối trung bình của nguyên tố X.
Phân tích và Lời giải:
Gọi số neutron của đồng vị (text{X}^A) là (N_A) và số neutron của đồng vị (text{X}^B) là (N_B).
Gọi số proton của nguyên tố X là Z (vì là cùng một nguyên tố, số proton bằng nhau).
Số khối của đồng vị (text{X}^A) là (A = Z + N_A).
Số khối của đồng vị (text{X}^B) là (B = Z + N_B).
Theo đề bài:
- Tổng số khối của hai đồng vị là 76: (A + B = 76)
- Hiệu số neutron của hai đồng vị là 2. Giả sử đồng vị B có số khối lớn hơn đồng vị A, suy ra (N_B – N_A = 2). Do A và B cùng số proton Z, nên ((Z+N_B) – (Z+N_A) = N_B – N_A = B – A = 2).
Ta có hệ phương trình:
[ begin{cases} A + B = 76 \ B – A = 2 end{cases} ] Giải hệ này, ta được (2B = 78 Rightarrow B = 39) và (A = 76 – 39 = 37).
Vậy, hai đồng vị có số khối là 37 và 39. Ký hiệu là (text{X}^{37}) và (text{X}^{39}).
Đồng vị (text{X}^{37}) (số khối A=37) chiếm 25% tổng số nguyên tử.
Đồng vị (text{X}^{39}) (số khối B=39) chiếm phần trăm còn lại: (100% – 25% = 75%).
Áp dụng công thức tính nguyên tử khối trung bình:
[ overline{A}_X = frac{(A times %_A) + (B times %_B)}{100} ]
[ overline{A}_X = frac{(37 times 25) + (39 times 75)}{100} ]
[ overline{A}_X = frac{925 + 2925}{100} = frac{3850}{100} = 38,5 ]
 Các bước giải bài tập tính nguyên tử khối trung bình của hai đồng vị Clo 35 và 37.
Các bước giải bài tập tính nguyên tử khối trung bình của hai đồng vị Clo 35 và 37.
Vậy, nguyên tử khối trung bình của nguyên tố X là 38,5 amu. Lưu ý: Hình ảnh minh họa có thể dùng cho ví dụ khác (Clo), nhưng nguyên tắc tính toán là tương tự.
Ví dụ 2: Tính số nguyên tử của một đồng vị trong lượng chất xác định
Đề bài: Clo (Cl) trong tự nhiên có hai đồng vị chính: (text{Cl}^{35}) và (text{Cl}^{37}). Tỉ lệ số nguyên tử của hai đồng vị này là 3:1 (tức (text{Cl}^{35}) chiếm 75%, (text{Cl}^{37}) chiếm 25%). Tính số nguyên tử của đồng vị (text{Cl}^{37}) có trong 14,6 gam axit clohidric (HCl). (Biết nguyên tử khối trung bình của Cl là 35,5 amu, nguyên tử khối của H là 1 amu).
Phân tích và Lời giải:
Trước hết, tính khối lượng mol của HCl.
(M_{HCl} = MH + overline{A}{Cl} = 1 + 35,5 = 36,5 text{ gam/mol}).
Tính số mol của HCl trong 14,6 gam:
(n{HCl} = frac{m{HCl}}{M_{HCl}} = frac{14,6}{36,5} = 0,4 text{ mol}).
Mỗi phân tử HCl chứa một nguyên tử Clo. Do đó, số mol nguyên tử Clo trong 0,4 mol HCl cũng là 0,4 mol.
(n{Cl} = n{HCl} = 0,4 text{ mol}).
Clo tự nhiên là hỗn hợp của hai đồng vị (text{Cl}^{35}) và (text{Cl}^{37}) với tỉ lệ số nguyên tử 3:1. Điều này có nghĩa là cứ 4 nguyên tử Clo bất kỳ, trung bình có 3 nguyên tử là (text{Cl}^{35}) và 1 nguyên tử là (text{Cl}^{37}).
Tỷ lệ số mol cũng tương ứng với tỷ lệ số nguyên tử.
Số mol của đồng vị (text{Cl}^{37}) trong 0,4 mol Clo là:
(n{Cl^{37}} = n{Cl} times frac{text{Tỉ lệ Cl}^{37}}{text{Tổng tỉ lệ}} = 0,4 times frac{1}{3+1} = 0,4 times frac{1}{4} = 0,1 text{ mol}).
Số nguyên tử của đồng vị (text{Cl}^{37}) trong 0,1 mol được tính bằng cách nhân số mol với số Avogadro ((NA = 6,022 times 10^{23}) nguyên tử/mol).
Số nguyên tử (text{Cl}^{37}) = (n{Cl^{37}} times N_A = 0,1 times 6,022 times 10^{23} = 6,022 times 10^{22}) nguyên tử.
 Hướng dẫn tính số nguyên tử của một đồng vị (Cl-37) trong một lượng chất cụ thể (HCl).
Hướng dẫn tính số nguyên tử của một đồng vị (Cl-37) trong một lượng chất cụ thể (HCl).
Vậy, trong 14,6 gam HCl có khoảng (6,022 times 10^{22}) nguyên tử của đồng vị (text{Cl}^{37}). Bài tập này minh họa cách kết hợp kiến thức về đồng vị, số mol và số Avogadro để giải quyết bài toán thực tế.
Kết luận
Đồng vị là một khái niệm cốt lõi trong nghiên cứu cấu trúc nguyên tử và sự đa dạng của các nguyên tố hóa học. Việc hiểu rõ định nghĩa đồng vị là gì, sự khác biệt về số neutron tạo nên các đồng vị khác nhau, cùng với các khái niệm liên quan như nguyên tử khối và nguyên tử khối trung bình, là nền tảng quan trọng để nắm vững kiến thức hóa học. Các ứng dụng rộng rãi của đồng vị trong y học, địa chất, vật lý hạt nhân, môi trường và công nghiệp cũng cho thấy tầm quan trọng thực tiễn của khái niệm này trong đời sống hiện đại. Hy vọng bài viết này đã cung cấp những thông tin chi tiết và hữu ích, giúp bạn đọc hiểu sâu hơn về đồng vị và các bài toán liên quan.


